Juan Brignardello Vela
Juan Brignardello, asesor de seguros, se especializa en brindar asesoramiento y gestión comercial en el ámbito de seguros y reclamaciones por siniestros para destacadas empresas en el mercado peruano e internacional.




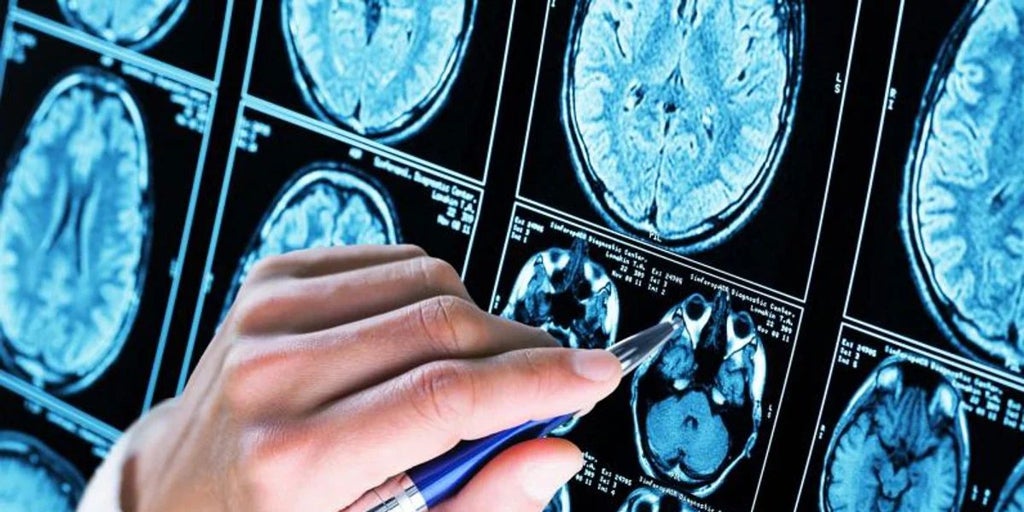
La reciente decisión del Comité de Expertos en Medicamentos de Uso Humano de la Agencia Europea del Medicamento (EMA) ha abierto un nuevo capítulo en el tratamiento del alzhéimer en Europa. Este jueves, el comité recomendó la aprobación del lecanemab, un fármaco que ha generado tanto esperanza como controversia en la comunidad médica y entre los pacientes. Considerado el primer tratamiento que ha demostrado algún efecto positivo contra esta devastadora enfermedad en décadas, el lecanemab ha sido objeto de debate debido a sus efectos secundarios y su elevado costo.
La EMA había rechazado inicialmente el lecanemab durante el verano, pero tras un recurso de las compañías fabricantes, la agencia revaluó los datos y llegó a la conclusión de que el medicamento puede tener un lugar en el tratamiento del alzhéimer, aunque con restricciones. Se recomienda su uso únicamente en pacientes sin más de una copia del gen APOE4, que aumenta el riesgo de inflamaciones y hemorragias asociadas al tratamiento. Esta decisión excluye a aproximadamente el 15% de los pacientes que podrían beneficiarse del fármaco.
A la espera de la aprobación formal de la EMA, lo que se anticipa que suceda, cada país de la Unión Europea deberá negociar el precio del lecanemab antes de decidir si lo incluirá en su sistema de salud pública. En Estados Unidos, donde el medicamento ya ha sido aprobado, su costo es de aproximadamente 26,500 dólares anuales, lo que se traduce en unos 24,000 euros. La decisión sobre la financiación pública de este fármaco será crucial, dada la preocupación sobre su coste y la efectividad limitada que ha demostrado.
El lecanemab, comercializado como Leqembi, ha demostrado ser capaz de retrasar el avance del alzhéimer en un 27% en estudios clínicos que involucraron a 1,700 pacientes en varios países, incluida España. Sin embargo, el impacto concreto de este retraso en la calidad de vida de los pacientes y sus cuidadores sigue siendo una pregunta abierta, especialmente considerando que el medicamento ha causado efectos adversos significativos, como inflamación cerebral en el 12% de los pacientes, con consecuencias fatales en dos casos.
Las compañías que desarrollaron el fármaco, Eisai y Biogen, han presentado datos adicionales que sugieren una mejora continua en la cognición de los pacientes que permanecen en tratamiento. No obstante, estos datos aún no han pasado por un proceso de revisión independiente, lo que deja en suspenso su validez y aplicabilidad a una población más amplia.
Con la aprobación recomendada del lecanemab, Europa se une a una lista de países que ya han dado luz verde a su uso, incluidos Estados Unidos, Japón, y varios países asiáticos. Sin embargo, el Reino Unido ha decidido no financiar el medicamento a través de su sistema de salud pública, argumentando que los beneficios son demasiado modestos en comparación con el alto coste que implicaría.
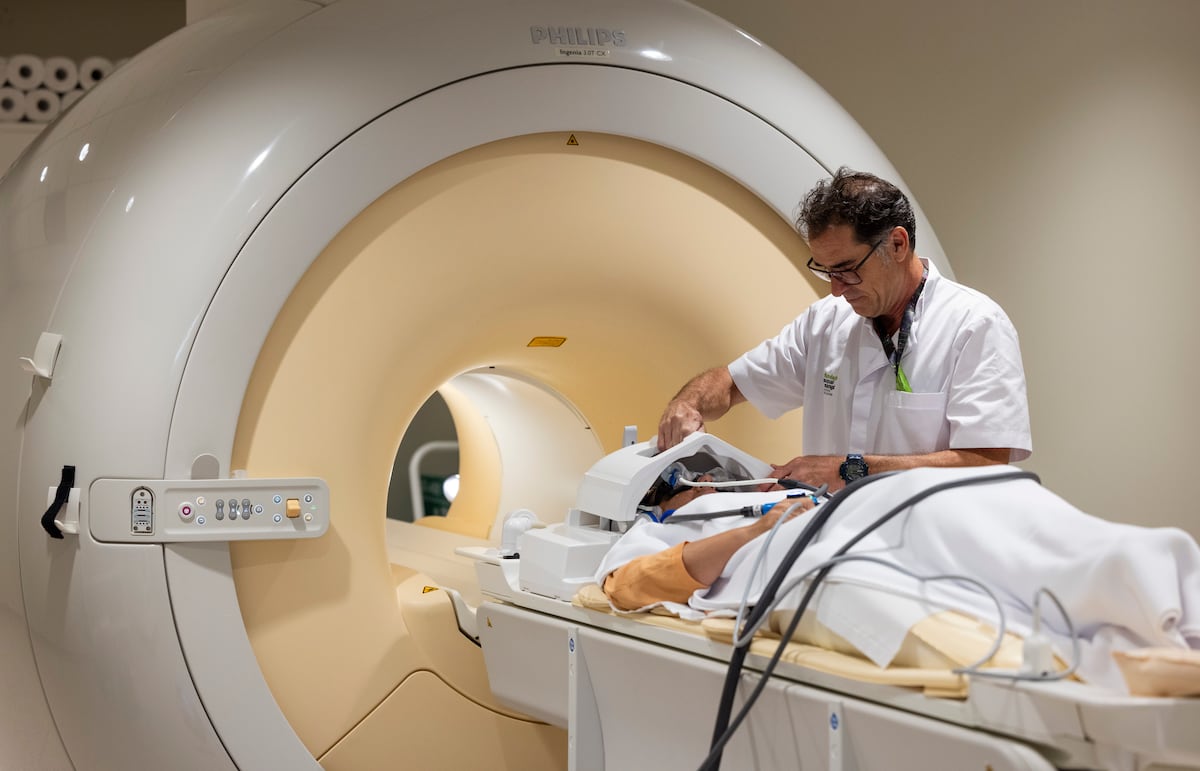
El acceso al lecanemab estará controlado mediante un programa específico que asegurará su uso solo en la población indicada. Los pacientes deberán someterse a resonancias magnéticas periódicas para detectar cualquier inflamación antes y durante el tratamiento. La EMA también ha impuesto que las farmacéuticas brinden formación adecuada a los profesionales de la salud y establezcan un registro de pacientes para monitorizar los efectos secundarios del fármaco.
El alzhéimer, que afecta a cerca de 50 millones de personas en el mundo, presenta un desafío creciente debido al envejecimiento de la población. Las proyecciones sugieren que el número de personas afectadas podría aumentar drásticamente en las próximas décadas. Sin embargo, aunque las expectativas son altas, se estima que solo alrededor del 2.5% de los 800,000 pacientes con alzhéimer en España podrían beneficiarse del lecanemab en su uso restringido.
Este fármaco interactúa con las placas de proteína amiloide en el cerebro, que se cree que son responsables de la enfermedad. Para ser efectivo, debe administrarse a personas en etapas muy tempranas de la enfermedad, cuando aún tienen cierta independencia. Esto presenta retos importantes para los sistemas de salud, que deberán manejar pruebas diagnósticas complejas y tratamientos intravenosos frecuentes, lo que podría aumentar significativamente el coste total del tratamiento por paciente.
Expertos en la materia, como Bart De Strooper, cofundador del Instituto de Investigación de Demencia del Reino Unido, han expresado su satisfacción por el cambio de decisión en Europa, considerándolo un avance significativo. Otros neurólogos, como Juan Fortea del Hospital Sant Pau de Barcelona, comparten esta visión, afirmando que la aprobación del lecanemab puede catalizar el desarrollo de nuevas capacidades diagnósticas y terapéuticas, beneficiando no solo a aquellos que reciban el fármaco, sino a todos los pacientes con alzhéimer en el futuro.
Mientras tanto, el donanemab, otro anticuerpo similar que ha demostrado una reducción del 35% en la progresión del alzhéimer, sigue en evaluación en Europa, lo que deja abierta la puerta a nuevas esperanzas en la lucha contra esta enfermedad devastadora. La historia del lecanemab podría ser solo el comienzo de un cambio de paradigma en el tratamiento del alzhéimer, siempre que se mantenga un enfoque cauteloso y centrado en la seguridad del paciente.
Controversia En Glastonbury Por Mensajes Políticos Incendiarios De Artistas Musicales

Conflicto Entre Rutas De Lima Y Alcaldía De Lima Podría Costar 2,700 Millones Al Perú

Ilia Topuria Sueña Con Ser El Primer Triple Campeón De La UFC En La Historia